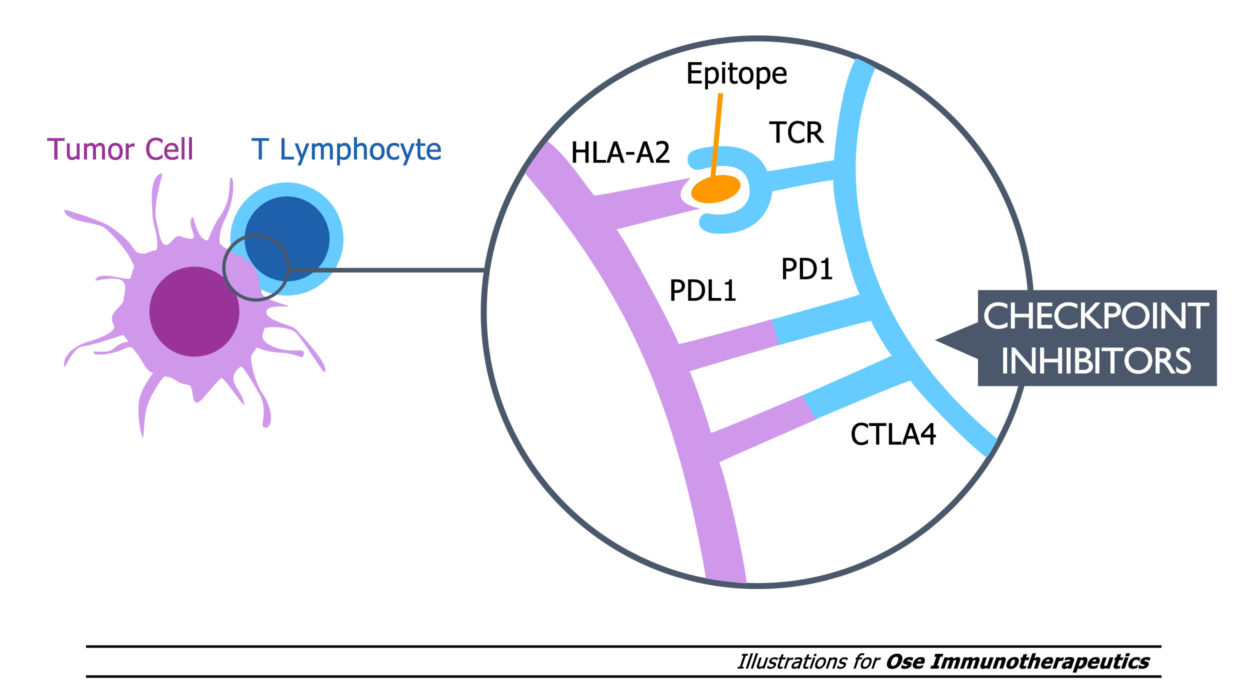
Tedopi® est également évalué en Phase 2 clinique dans :
- Le cancer du poumon non à petites cellules, en combinaison avec Opdivo® (nivolumab), un essai promu par la Fondation italienne en oncologie FoRT.
- Le cancer du pancréas, un essai promu par le groupe coopérateur en oncologie GERCOR.
- Le cancer de l’ovaire, en combinaison avec Keytruda® (pembrolizumab), un essai promu par le groupe coopérateur en oncologie ARCAGY-GINECO.
A PROPOS DU PROGRAMME CLINIQUE TEDOPI®
Tedopi® est évalué dans trois indications majeures de cancer :
- Phase 3 d’enregistrement dans le cancer du poumon non à petites cellules (CPNPC) en deuxième ligne de traitement chez des patients en résistance secondaire aux inhibiteurs de points de contrôle (IPC)
Artemia est un essai clinique international de Phase 3, randomisé, en ouvert, comparant l’efficacité et la tolérance de Tedopi® en monothérapie versus le traitement standard chez des patients HLA-A2 positifs souffrant d’un CPNPC métastatique, en résistance secondaire aux IPC. Le critère principal est la survie globale. Cet essai pivot confirmatoire inclura 363 patients et vise à soutenir l’enregistrement réglementaire deTedopi® en deuxième ligne de traitement du CPNPC aux États-Unis, au Canada, en Europe et au Royaume-Uni.
(1) Après au moins 12 semaines de traitement de maintenance par IPC en monothérapie sans traitement cytotoxique (Task force SITC 2020 – Kluger H et al. 2020). Kluger et al. 2023
Clinicaltrials.gov: NCT06472245
L’essai Artemia, dernière étape de développement avant l’enregistrement de Tedopi®, est soutenu par les résultats positifs et prometteurs de la première étude de Phase 3, nommée Atalante-1, menée en troisième ligne de traitement du CPNPC.
Cet essai international de Phase 3 randomisé a permis de démontrer un bénéfice thérapeutique significatif chez les patients en résistance secondaire aux IPC, définie par des patients en échec à une chimiothérapie à base de platine suivie par un minimum de 12 semaines d’un traitement par IPC (analyse principale de l’essai). Tedopi® a montré un ratio bénéfice/risque favorable par rapport au traitement standard (docetaxel ou pemetrexed) chez les patients HLA-A2 positifs, atteints d’un CPNPC en résistance secondaire aux IPC.
Un article, intitulé : “Randomized Open-Label Controlled Study of Cancer Vaccine OSE2101 Versus Chemotherapy in HLA-A2-positive Patients with Advanced Non-Small Cell Lung Cancer with Resistance to Immunotherapy: ATALANTE-1” publié dans la revue à Comité de lecture Annals of Oncology a décrit ces résultats positifs.
Clinicaltrials.gov: NCT02654587
- Phase 2 en combinaison avec Opdivo® (nivolumab) après une première ligne de chimio-immunothérapie (promotion FoRT)
L’essai de Phase 2 comprend 3 bras de traitement et évalue Tedopi® en combinaison avec Opdivo® (nivolumab), le checkpoint inhibiteur immunitaire de Bristol Myers Squibb, ou Tedopi® en combinaison avec une chimiothérapie versus chimiothérapie seule en deuxième ligne de traitement chez des patients HLA-A2 positifs atteints d’un cancer du poumon métastatique non à petites cellules, après une première ligne de chimio-immunothérapie. Le critère principal est la survie à 1 an.
Clinicaltrials.gov: NCT04884282
Le cancer du pancréas
L’essai de Phase 2 TEDOPaM (promotion GERCOR) vise à comparer Tedopi® en combinaison avec la chimiothérapie FOLFIRI versus FOLFIRI, en traitement de maintenance après un traitement d’induction par FOLFIRINOX. Le critère principal de l’essai est le taux de survie à un an.
Clinicaltrials.gov : NCT03806309
Le cancer de l’ovaire
L’essai de Phase 2 TEDOVA (promotion ARCAGY-GINECO) comprend 3 bras de traitement et évalue Tedopi® en traitement de maintenance en monothérapie ou en combinaison avec l’anti-PD-1 Keytruda® (pembrolizumab) versus le traitement de référence chez des patientes atteintes d’un cancer de l’ovaire en situation de rechute platine sensible, et dont la maladie est contrôlée après chimiothérapie avec platine. Le critère principal est la durée de survie sans progression.
Clinicaltrials.gov: NCT04713514